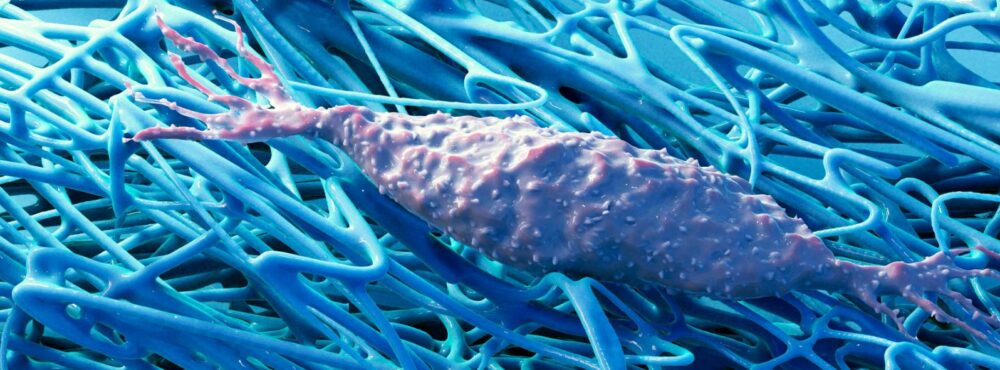
La matrice interstitielle pour glisser
Aussi novatrice que soit cette description du système myofascial, l’aspect le plus déterminant des travaux récents sur les fasciae concerne sans doute les espaces interstitiels qui constituent la partie liquidienne de la MEC intercalée entre chacune des couches fasciales. En effet, les nouvelles méthodes de dissection évoquées précédemment non pas seulement permis de montrer la réalité de couches fasciales distinctes mais également de faire apparaitre les lames liquidiennes s’immisçant entre elles : le tissu conjonctif lâche (TCL).

Prélevés et analysés au microscope, des échantillons de TCL ont montré qu’il consiste en un gel de substance fondamentale fortement aqueux structuré par des protéoglycanes (PG) ou un glycosaminoglycane (GAG), l’acide hyaluronique (AH). A l’instar des éléments matriciels membraneux composée d’éléments fibreux (majoritairement collagènes et élastine), le TCL est secrété par des fibroblastes en grande partie en réponse aux stimulis mécaniques qu’ils perçoivent 1, 2. La nature différente des composants secrétés dépendrait du type de contraintes auxquels ils réagissent, les fibroblastes construisant les membranes étant sensibles aux tractions, ceux structurant les espaces interstitiels aux compressions et aux cisaillements des tissus. Les microbiologistes spécialistes de la MEC ont découvert de nombreux PG intervenant dans la consistance matricielle qui, s’ils jouent un rôle mécanique essentiel, assument également des fonctions de signalisation impliqués dans la régulation de divers processus cellulaires 3. Ce qui laisse entrevoir un « dialogue » mécanosensoriel entre les cellules et leur microenvironnement. Par ailleurs, l’AH 4 semble posséder des propriétés rhéologiques interstitielles essentielles au glissement interfasciaux et l’équipe de Carla Stecco a mis en évidence une variété de fibroblastes sécrétant spécifiquement de l’AH, les fasciacytes 5. Capable de créer de grandes structures polymériques capturant les molécules d’eau, il possèderait des propriétés lubrifiantes exceptionnelles nécessaires aux glissements des couches membraneuses entre elles 6, 7. La consistance visco-élastique du TCL qui fluctue de liquide à celle d’un gel plus ou moins visqueux, comme la sécrétion et la polymérisation de l’AH, dépendent des conditions électrochimiques matricielles locales 8, 9, notamment de la température ou du pH, mais également, en raison de la mécanosensibilité des fibroblastes, des forces qui parcourent la MEC.
La mécanosensorialité au cœur de la danse fasciale
Si les glissements des couches fasciales entre elles sont nécessaires aussi bien à l’animation et à la coordination de système myofascial de l’enveloppe corporelle, la sensibilité mécanique est un aspect central indispensable à la régulation de cette chorégraphie. Cette mécanosensorialité se situe à chaque niveau d’organisation puisqu’elle implique la mécanosensitivité des cellules 10 communiquant avec leur microenvironnement et la mécanoréception des tissus dont une multiplicité de capteurs fournit les informations proprioceptives et tactiles au système neuro-musculaire. Au fur et à mesure de l’évolution, à l’instar des cellules, les tissus se sont dotés de différents type de récepteurs disséminés dans l’ensemble du réseau fascial assurant la perception de toute une palette de stimuli nécessaire au contrôle du mouvement. Comme l’a montré Schleip 11, les modèles de régulation proprioceptifs ne recensent qu’une partie limitée des capteurs impliqués dans la régulation de la posture et du mouvement. Les récepteurs de Golgi, réagissant à la traction, ne sont par exemple étudiés que pour leur présence au sein des tissus tendineux alors qu’ils semblent être disséminés dans l’ensemble des tissus fasciaux. Les récepteurs de Pacini/Paciniformes comme ceux de Ruffini réagissent à la pression, fugace pour les premiers, prolongée pour les seconds sont présents dans nombre de structures fasciales et leur répartition semble liée aux fonctions spécifiques assumées par ces tissus. Plus intéressant : l’étude d’un nerf spécifique d’un muscle, comme le nerf tibial, montre qu’il contient trois quarts de fibres sensitives pour un quart seulement de motrices et surtout que si l’on recense des fibres I et II affectées aux récepteurs mentionnés précédemment, on dénombre quatre fois plus de fibres III et IV véhiculant l’information capteurs quasiment ignorés par les chercheurs. Ces récepteurs semblent être des capteurs interstitiels présents dans presque tous les tissus fasciaux, notamment dans le périoste, pour lesquels le Pr Schleip propose la dénomination de récepteurs tissulaires myofasciaux interstitiels. Impliqués aussi bien dans la thermo et la chémoception que dans la mécanoperception, ils réagiraient aux modifications de la vasodilatation (notamment l’extravasation plasmatique) comme aux mouvements articulaires et à l’étirement cutanée et fascial. Ils déclencheraient également des réponses neurovégétatives avec des modifications de la fréquence cardiaque, de la tension, de la respiration.
Comme les fasciae longtemps ignorés en raison du manque d’intérêt qu’ils suscitaient auprès des anatomistes, les récepteurs mécaniques qu’ils abritent n’ont fait que peu l’objet d’investigations scientifiques. L’évolution des conceptions fonctionnelles de l’appareil locomoteur, fondés jusqu’ici sur un modèle discret de contrôle articulaire par le système neuro-musculaire, doit prendre en compte l’ensemble de ces récepteurs dans le continuum myofascial de l’enveloppe corporelle. La continuité tissulaire de ce réseau s’accompagnant d’une continuité sensorielle dont la dissémination des récepteurs varie selon les fonctions assumées par chaque région. En superficie, la dissociation sensibilité tactile/proprioception assurée structurellement par les espaces créent par les retinaculum entre la peau et les fascias superficiel et profond permet d’individualiser la sensibilité tactile et de la proprioception, la perception de l’environnement et le mouvement. Sauf dans les régions en contact direct avec l’environnement au niveau plantaire et palmaire où les deux structures fusionnent pour, semble-t-il apporter la meilleure connexion à l’environnement. La double nature des contraintes mécaniques, en traction et en pression, fait également l’objet de mécanorécepteurs différents dont l’importance de la présence au sein des tissus dépend là aussi des nécessités fonctionnelles. On peut ainsi observer que dans les jonctions myotendineuses les organes tendineux de Golgi sont plus présents aux confins du muscle alors que les corpuscules de Pacini deviennent plus nombreux quand on s’en éloigne. Enfin, la multiplicité des capteurs interstitiels apporte une réactivité neuro-végétative essentielle à la régulation liquidienne autant locale que générale : impliquée dans les processus vaso-dilatatoires locaux aussi bien que dans la régulation de la pression artérielle ou la fréquence cardiaque.
Densification : la double vie des fibroblastes
L’illustration la plus remarquable de cette interaction mécanique entre les niveaux cellulaires et tissulaires est certainement le développement des retinaculum, tout particulièrement pendant les premières années de la vie où l’enfant acquiert ses compétences locomotrices. À la naissance, l’enveloppe corporelle présente déjà sa structure multicouche, les contractions des muscles lors des mouvements intra-utérin du bébé ayant déjà stimulé l’action fibroblastique façonnant l’axe des trames collagènes. Cependant, les fasciae péri articulaires restent relativement informes sans organisation, ce qui ne permet pas au jeune humain de marcher et encore moins de courir. La découverte et l’exploration du monde extra-utérin soumis à la gravité vont peu à peu mettre son système myofascial à l’épreuve des contraintes. Ses fibroblastes vont construire lentement, surtout pendant les trois premières années de sa vie aérienne, des réseaux péri-articulaires de trames collagéniques denses, les retinaculum, destinés à créer des « rails » fonctionnels de maintien antigravitaire. En interaction permanente avec son système neuro-musculaire, cette armature fasciale lui permet d’acquérir progressivement les capacités visco-élastiques spécifiques nécessaires au maintien de son squelette axial (vers 6 mois), de se tenir debout (vers 1 an) puis de marcher de manière sûre pour enfin posséder l’élasticité essentielle à l’impulsion des sauts de la course. Spécifique aux humains, la locomotion bipède tire parti des propriétés élastiques tissulaires de ce réseau de densification des retinaculum : moins performante en puissance et en vitesse que la quadrupédie des autres mammifères, elle lui confère une économie énergétique adaptée à ses exceptionnelles capacités d’endurance 12.
Cependant, cette capacité de construction des fibroblastes en réponses aux contraintes mécaniques si nécessaires à la croissance du corps présente une face sombre… En effet, l’action de ces bâtisseurs infatigables ne s’arrête pas à l’âge adulte mais se perpétue tout au long de la vie de l’organisme 13,14. Réagissant aux modifications du microenvironnement occasionnés par les processus inflammatoires 15, que celui-ci soit lié à une agression traumatique locale (entorse, fracture, contusion…) ou à des modifications métaboliques plus générales médiées par des stimuli humoraux (notamment le facteur de croissance TGF-β se coordonnant avec d’autres plus spécifiques tels que CTGF, PDGF, NGF et IDF 1…), les fibroblastes vont activer leur production matricielle. Ne répondant pas aux stimulations mécaniques fonctionnelles, ils vont sécréter ou résorber les composants matriciels aussi bien membraneux (principalement des fibres de collagènes) que liquidien (PG et AH 16) reconfigurant la MEC de manière anarchique que l’on peut observer au microscope 17, 18. Si les conditions inflammatoires locales, normalement transitoire dans un développement cicatriciel normal, perdurent, ce remaniement matriciel va altérer durablement la structure tissulaire locale : on parle alors de fibrose.

Aspects cliniques de la densification pathologique
Modifiant les propriétés mécaniques du tissu fascial et la qualité de ses glissements, la fibrose se manifeste cliniquement comme une densification locale détectée assez facilement par la main des thérapeutes manuels. Perçue comme une aspérité, un « grumeau » dans la fluidité générale du système fascial, la difficulté pour le praticien tiendra moins à sa capacité à déceler cette densification qu’à sa faculté à identifier la zone où elle se situe 19, 20. En effet, générant localement une concentration de contraintes, cette densification fibrotique va altérer la transmission des forces à distance, particulièrement par l’intermédiaire du réseau des retinaculum. Peu à peu, elle va modifier toute la mécanique de la toile fasciale et la mécanoperception entrainant une modification des stratégies locomotrices. Au cours du temps, le système va s’adapter en trouvant un nouvel équilibre mais en générant un certain nombre de points de tension, densifications secondaires qui vont à leur tour générer des surcontraintes et activer des mécanorécepteurs distants. A terme, lorsque dans une zone fasciale, l’activation sensorielle de ces récepteurs devient trop intense et dépasse le seuil nociceptif, elle devient douloureuse. On parle alors de lombalgie, de cervicalgie, de talalgie, toutes ces algies qui rendent notre corps tout à coup insupportable, étranger et le mouvement si pénible…
Il apparait ainsi évident que la zone douloureuse, symptomatique, le réseau de tension, les densifications secondaires et celle à l’origine du processus constitue un jeu de piste que le praticien devra suivre afin d’apporter une solution aux plaintes du patient. Cependant, il serait vain de rechercher manuellement les zones densifiées, la palpation exhaustive de la seule surface corporelle prendrait trop de temps. De plus, cela supposerait que seule celle-ci impliquée dans ces processus. Or, elle ne représente que la partie superficielle, la plus abordable, de notre réseau fascial affectée à la locomotion. Comme les icebergs dans l’océan, la partie la plus importante se trouve immergée. Chacun de nos organes, notamment nos viscères et notre système nerveux, à l’instar de l’enveloppe corporelle locomotrice, sont des constructions matricielles complexes susceptibles également d’être le siège de densifications. Préservant leur intégrité et les rattachant à l’enveloppe corporelle, ils sont enveloppés de fasciae d’investissement et d’insertion, comme les fasciae épimysiaux et aponévrotiques de nos muscles, qui les relient au réseau tensionnel fascial 21. Cependant, la sensibilité intéroceptive propres à ce réseau profond nous est moins perceptible, n’affectant que peu notre proprioception. Ainsi lorsque les fibroses affectent nos organes, les concentrations de contraintes qu’elles induisent vont se propager silencieusement, par ce réseau fascial enfoui, jusqu’à l’enveloppe corporelle. C’est par elle que nous percevrons les stimulis nociceptifs, douloureux, qui résultent des tensions causées par ces fasciae internes. Nombre de douleurs que nous percevons à la surface de notre corps ne sont ainsi bien souvent que des sensations projetées pour lesquelles le praticien devra apprendre à « lire les corps ». Pour cela, il devra maitriser l’ensemble de l’anatomie fasciale et intégrer le réseau complexe des fasciae internes, viscéraux voir méningés et l’interaction mécanosensorielle complexe qu’ils sous-tendent. Mais peut-être avant tout chose, c’est l’histoire mécanobiologique de chacun des événements susceptibles d’être une source dysfonctionnelle de stimulation des fibroblastes, à l’origine de la densification, qui devra être interrogée. Mêlant les connaissances anatomiques, biologiques et histologiques des tissus et la compréhension des mécanismes physiopathologiques menant de la dysfonction à la fibrose, cette investigation corporelle quasi psychanalytique est une aventure thérapeutique conjointe, à la recherche des zones intimes où se nouent les densifications fasciales à l’origine de la plainte du patient. Alliant ces compétences thérapeutiques à sa maîtrise technique et à son expérience, le praticien manuel contribuera ainsi à lui permettre de retrouver la fluidité de son corps et le plaisir de faire danser ses fasciae.
Bibliographie
- Argentati, C., Morena, F., Tortorella, I., Bazzucchi, M., Porcellati, S., Emiliani, C., & Martino, S. (2019). Insight into Mechanobiology: How Stem Cells Feel Mechanical Forces and Orchestrate Biological Functions. International Journal of Molecular Sciences, 20
- Chiquet, M., Gelman, L., Lutz, R., & Maier, S. (2009). From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochimica et biophysica acta, 1793 5, 911-20.
- Schaefer, L., & Schaefer, R.M. (2009). Proteoglycans: from structural compounds to signaling molecules. Cell and Tissue Research, 339, 237-246.
- Itano, N. (2008). Simple primary structure, complex turnover regulation and multiple roles of hyaluronan. Journal of biochemistry, 144 2, 131-7 .
- Stecco, C., Fede, C., Macchi, V., Porzionato, A., Petrelli, L., Biz, C., Stern, R.A., & De Caro, R. (2018). The fasciacytes: A new cell devoted to fascial gliding regulation. Clinical Anatomy, 31
- Cowman, M.K., Schmidt, T.A., Raghavan, P., & Stecco, A. (2015). Viscoelastic Properties of Hyaluronan in Physiological Conditions. F1000Research, 4.
- Pratt, R.L. (2021). Hyaluronan and the Fascial Frontier. International Journal of Molecular Sciences, 22.
- Tammi, M., Day, A.J., & Turley, E.A. (2002). Hyaluronan and Homeostasis: A Balancing Act*. The Journal of Biological Chemistry, 277, 4581 – 4584.
- Fallacara, A., Baldini, E., Manfredini, S., & Vertuani, S. (2018). Hyaluronic Acid in the Third Millennium. Polymers, 10.
- Huang, G., Xu, F., Genin, G.M., & Lu, T.J. (2019). Mechanical microenvironments of living cells: a critical frontier in mechanobiology. Acta Mechanica Sinica, 35, 265-269.
- Schleip, R. (2003). Fascial plasticity – a new neurobiological explanation: Part 1. Journal of Bodywork and Movement Therapies, 7, 11-19.
- Bramble, D.M., & Lieberman, D.E. (2004). Endurance running and the evolution of Homo. Nature, 432, 345-352.
- Phillip, J.M., Aifuwa, I., Walston, J.D., & Wirtz, D. (2015). The Mechanobiology of Aging. Annual review of biomedical engineering, 17, 113-141 .
- Bordoni, B., & Zanier, E. (2015). Understanding Fibroblasts in Order to Comprehend the Osteopathic Treatment of the Fascia. Evidence-based Complementary and Alternative Medicine : eCAM, 2015.
- D’Urso, M., & Kurniawan, N.A. (2020). Mechanical and Physical Regulation of Fibroblast–Myofibroblast Transition: From Cellular Mechanoresponse to Tissue Pathology. Frontiers in Bioengineering and Biotechnology, 8.
- Stecco, C., Stern, R.A., Porzionato, A., Macchi, V., Masiero, S., Stecco, A., & Caro, R.D. (2011). Hyaluronan within fascia in the etiology of myofascial pain. Surgical and Radiologic Anatomy, 33, 891-896.
- Frantz, C., Stewart, K.M., & Weaver, V.M. (2010). The extracellular matrix at a glance. Journal of Cell Science, 123, 4195 – 4200.
- Yang, S., & Plotnikov, S.V. (2021). Mechanosensitive Regulation of Fibrosis. Cells, 10.
- Langevin, H.M. (2021). Fascia Mobility, Proprioception, and Myofascial Pain. Life, 11.
- Pavan, P.G., Stecco, A., Stern, R.A., Prat, P.L., & Stecco, C. (2016). Fibrosis and densification: Anatomical vs functional alteration of the fascia. Journal of Bodywork and Movement Therapies, 20, 151.
- Stecco, C., Sfriso, M.M., Porzionato, A., Rambaldo, A., Albertin, G., Macchi, V., & De Caro, R. (2017). Microscopic anatomy of the visceral fasciae. Journal of Anatomy, 231.