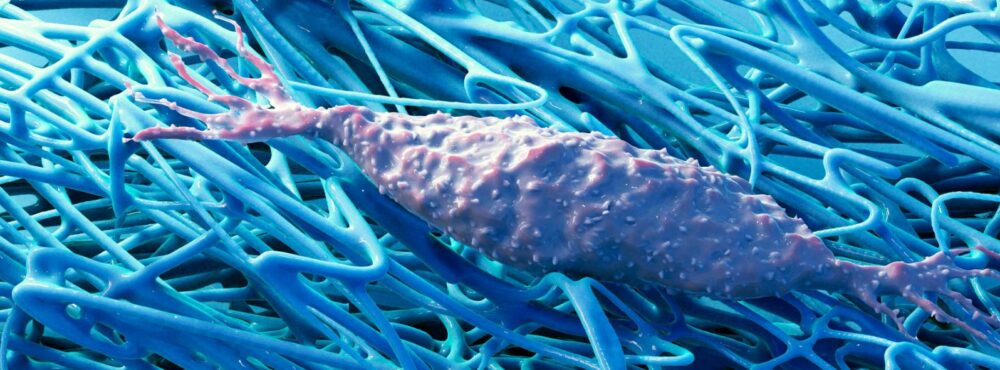
Les intuitions de Bichat
Comme nous l’avons déjà évoqué (voir l’histoire anatomique des fasciae), la description anatomique des fasciae et du réseau qu’ils tissent au sein de l’organisme est récent. Cependant, dès la fin du XVIIIème siècle, le français Xavier Bichat dans son « Traité des membranes en général et de diverses membranes en particulier » (1799), s’il déplore le manque d’attention accordé aux membranes qui « n’ont point été jusqu’ici un objet de particulier de recherche pour les Anatomistes. » a déjà l’intuition de ce réseau quand il poursuit : « Ce genre d’organes, disséminé pour ainsi dire dans tous les autres, concourant à la structure du plus grand nombre, ayant rarement une existence isolée, n’a jamais été isolément examiné par eux. » Et il insiste plus loin en remarquant que les « organes doivent différer, non-seulement par la manière dont est arrangée, entrecroisée, la fibre qui les forme ; mais encore par la nature de cette fibre elle-même ; qu’il y a entre eux différence de composition, comme de tissu. ». Ses observations à l’œil nu mais encore plus au microscope, font apparaitre l’aspect ubiquitaire de ses structures membraneuses qui s’immiscent partout et se manifestent par des conformations et des propriétés fonctionnelles propres à chaque organe afin de répondre à ses spécificités.
De l’anatomie à la micro-histologie
Avec la théorie cellulaire de Schwann et Schleiden en 1848, la cellule devient l’élément central du paradigme biologique moderne. Tout à l’enthousiasme d’avoir trouvé l’unité de base du vivant, les biologistes établissent une classification des tissus, établie avec les microscopes optiques de l’époque définissant les différents types tissulaires selon la nature des cellules participant à leur constitution. Encore actuellement, la plupart des ouvrages décrivent les tissus selon les types de cellules qui les composent en distinguant trois types parenchymateux, épithéliaux, nerveux et musculaires et le quatrième, ubiquitaire bien qu’extrêmement varié, conjonctif. A l’instar des membranes en anatomie, ces derniers ont longtemps été reléguées à un rôle structurel de soutien, « une charpente dans laquelle sont intégrées les cellules » 1. Cependant, peu à peu grâce au progrès conjoints de la biochimie, de la biologie cellulaire puis moléculaire ainsi que des technologies d’imagerie au cours de la deuxième moitié du XXème siècle, les biologistes changent d’échelle et commencent à observer la multiplicité les composants des structures tissulaires. Un micromonde extrêmement complexe commence à leur apparaitre qui modifie radicalement la conception des organes et de leurs tissus constitutifs.

Coloration Hémalun Phloxine – Grossissement x 400
Coupe histologique dans la sous-muqueuse de l’oesophage avec un tissu conjonctif très riche en fibres élastiques. On distingue également de nombreux fibroblastes, cellules fusiformes, sécrétant ces fibres ainsi que des capillaires sanguins assurant un rôle de nutrition.
Tissus conjonctifs et Matrice Extra-Cellulaire
La conception générique des tissus conjonctifs évolue dès lors vers un nouveau concept 2, la Matrice Extra-Cellulaire (MEC) regroupant les structures conjonctives non-cellulaires dont les différents constituants sont sécrétés par les cellules conjonctives. La distinction simpliste des quatre types tissulaires semble se dissoudre pour faire apparaitre un kaléidoscope extrêmement diversifié où, si la classification cellulaire semble subsister, la notion de tissus conjonctifs laisse place à une MEC polymorphe constituant toute l’architecture enceignant les cellules 3. La meilleure illustration de ce changement de paradigme tissulaire concerne certainement les lames basales sur lesquelles s’ancrent les cellules parenchymateuses. Partie intégrante de ces tissus parenchymateux, elles n’en sont pas moins un constituant matriciel conjonctif. Par ailleurs, depuis la découverte en 1973 de la fibronectine 4 et de son rôle d’adhésion et de modulation des interactions cellules/MEC via les intégrines, il est apparu qu’elles ne peuvent plus être considérées comme seulement un échafaudage passif. En effet, l’attachement des cellules à ce support est nécessaire à leur survie, à leur prolifération, à leur différenciation et à leur motilité et sa régulation est réalisée par un grand nombre de processus qui impliquent l’activation de mécanismes aussi bien matriciel qu’intra-cellulaire. La compréhension des interactions cellules-matrice fait apparaitre que si les cellules réalisent la synthèse des constituants de la MEC, les modifications de cette dernière déclenchent des adaptations cellulaires affectant ainsi leur détermination phénotypique.

On distingue la couche de cellules endothéliales,
séparée des pieds astrocytaires par la lame basale. Les neurones sont également entourés par les
prolongements astrocytaires.
Mécanosensibilité et construction des corps
Jusqu’à la fin du XXème siècle, la biologie cellulaire restait essentiellement centrée sur les interactions électrochimiques cellules/MEC. Cependant, un certain nombre d’avancées technologiques ont permis, ces vingt dernières années, la découverte et l’étude de récepteurs mécanosensibles 5, 6, 7 (intégrines, récepteurs de l’élastine, cadhérines, occludines…) démontrant la très grande variété des messages échangés et permettant d’établir les nouvelles bases de l’homéostasie 3. Leur étude fait maintenant partie intégrante de la compréhension des mécanismes du vivant participant à la constitution et à l’évolution des enceintes corporelles dans un véritable nouveau paradigme mécanobiologique. Il semble bien établi que toute modification, ou altération en cas de dysfonctionnement, des conditions matricielles électrochimiques ou mécaniques déclenchera une adaptation des réponses cellulaires. Inversement, les activités cellulaires auront des conséquences sur l’équilibre et la structure matricielle 8. Une telle conception dynamique de la MEC invite à envisager les corps, propres aux organismes complexes, comme des enceintes que les colonies cellulaires hôtes construisent et modèlent à chaque instant pour s’adapter et se déplacer dans l’espace. Il semble nécessaire qu’une nouvelle classification émerge où les trois types de cellules parenchymateuses conservent leurs singularités mais sans définir de tissus particuliers. En effet, s’il s’avère que toutes les cellules sont mécanosensibles et réagissent aux forces mécaniques qu’elles subissent et/ou qu’elles génèrent, certaines cellules conjonctives, les fibroblastes, jouent une rôle essentiel dans la structuration de la MEC.

Véritables cellules constructrices des corps, les fibroblastes 9 jouent un rôle central dans l’édification, la régulation et l’évolution des enceintes corporelles et devraient se trouver au cœur de cette nouvelle conception mécanobiologique. Ces cellules sont de véritables couteaux suisses mécanosensibles réagissant aussi bien aux forces de tractions qu’aux contraintes en compression et en cisaillement. En réponse aux premières, elles produisent des fibres de collagènes ou d’élastine nécessaires aux lames basales ou aux membranes fasciales, alors qu’en fonction des variations de pression tissulaires elles sécrètent des glycosaminoglycanes (GAG) et des protéoglycanes (PG) dont les capacités hydrophiles exceptionnelles confèrent à la MEC interstitielle ses propriétés visco-élastiques. Ainsi, elles réalisent en permanence l’adéquation cellules/MEC 10 nécessaire au maintien de la cohésion des enceintes corporelles, véhiculant ces colonies cellulaires dans le champ gravitaire terrestre. Au sein du microenvironnement, les fibroblastes construisent, résorbent, remanient, transforment les structures de la MEC à chaque instant, bâtisseurs mécanosensibles infatigables qui construisent et remanient sans cesse les tissus, les organes et les corps.

La partie supérieure montre que les cellules endothéliales perdent leurs marqueurs endothéliaux.
La partie inférieure montre que des facteurs mécaniques, tels que la dégradation ou la production d’ECM qui modifient la rigidité des tissus, peuvent induire la différenciation, par exemple dans les fibroblastes cardiaques 10.
Implications cliniques en thérapies corporelles
Cette vision dynamique des organismes complexes fondée en grande partie sur ces nouvelles connaissances de la mécanosensibilité 11 invitent à considérer d’un œil nouveau les approches thérapeutiques du corps. Ainsi que l’expose le Robert Schleip 12, il est nécessaire aux praticiens actuels de maitriser une bonne connaissance de chacun des niveaux d’organisation anatomique, tissulaire, matriciel et intracellulaire. Mais il semble qu’ils doivent surtout d’être capables d’appréhender les implications des mécanismes intervenant à chaque niveau sur les niveaux sus et sous-jacents. Ainsi, l’entrainement chez un sportif fait intervenir l’appareil locomoteur au niveau anatomique, met en jeu le système fascial au niveau tissulaire et les fibroblastes et les cellules musculaires au niveau cellulaire. L’ensemble des mécanismes impliquant ces deux types cellulaires vont, après une période d’inflammation lié à l’altération des microstructures, en réparant ces microlésions, permettre un meilleur conditionnement de la MEC, plus solide et plus adapté aux efforts imprimés au corps. De même, c’est ce type de reconditionnement qui sera recherché après une immobilisation, au cours de la convalescence, afin de retrouver des conditions physiques fonctionnelles. La compréhension de ces processus par le thérapeute est essentielle pour adapter son traitement aux besoins physiques du patient mais également pour lui apprendre à décrypter les signaux de son corps en reconstruction et l’accompagner dans cette (re)découverte proprioceptive.
A l’inverse, lorsque l’organisme produit des réponses inflammatoires durables, perçues ou non, comme notamment les inflammations de bas grade liés au vieillissement ou aux maladies métaboliques, la MEC subit des changements structurels influant sur sa mécanique. De tels processus modifient la réponse des fibroblastes à l’origine d’une fibrose extracellulaire 13,14 modifiant les propriétés mécaniques des tissus. De manière aigüe, ces altérations pourront être source de douleurs myofasciales diverses (lumbago, lombalgies, cervicalgies…) et si elles se chronicisent de tendinopathies ou d’arthrose, de troubles viscéraux (troubles fonctionnels intestinaux, BPCO et emphysèmes…) participant aux processus de transformations de la MEC propres à l’ensemble des pathologies dégénératives.
MEC et interstitium
Au final, la notion de MEC constitue l’appellation modernisée du milieu intérieur chère à Claude Bernard au XIXème siècle, replaçant au centre de la nouvelle mécanobiologie l’interaction cellule/MEC au détriment d’une théorie cellulaire principalement axée sur l’expression génétique. C’est d’ailleurs dans cette dynamique qu’en 2005, Neil Theise 15 a suggéré un changement de paradigme en proposant une approche biologique moderne affirmant que la « théorie de la complexité, qui décrit l’auto-organisation émergente de systèmes adaptatifs complexes, a acquis une place prépondérante dans de nombreuses sciences. Un aspect puissant de l’auto-organisation émergente est que l’échelle importe. » Ses travaux ont abouti ces trois dernières années à des avancées décisives pour la conception du corps avec en 2018 la démonstration de la réalité des espaces interstitiels et de leur continuité au sein des tissus 16 et en 2020 en montrant la dynamique de la circulation interstitielle au sein de ces espaces 17. Il apporte ainsi les premières preuves biologiques définitives confirmant avec une approche scientifique moderne les intuitions des fondateurs de techniques ancestrales telles que l’acuponcture, le yoga ou d’A.T. Still pour l’ostéopathie.
Bibliographie
- Jacob, M.P. (2006). Matrice extracellulaire et vieillissement vasculaire. M S-Medecine Sciences, 22, 273-278.
- Labat-Robert, J., Robert, L., & Pouliquen, Y. (2011). Les tissus conjonctifs, de l’origine du concept à sa « mutation » en matrice extracellulaire. Application aux tissus oculaires. Contribution à l’histoire des sciences médicales. Pathologie Biologie, 59, 183-186.
- Frantz, C., Stewart, K.M., & Weaver, V.M. (2010). The extracellular matrix at a glance. Journal of Cell Science, 123, 4195 – 4200.
- Poulouin, L., Gallet, O., & Imhoff, J. (1997). La fibronectine : propriétés et fonctions de la molécule native et de ses fragments. M S-medecine Sciences, 13, 657-661.
- Jansen, K.A., Donato, D.M., Balcioglu, H.E., Schmidt, T., Danen, E.H., & Koenderink, G.H. (2015). A guide to mechanobiology: Where biology and physics meet. Biochimica et biophysica acta, 1853 11 Pt B, 3043-52 .
- Mège, R., & Ladoux, B. (2018). De l’irruption de la mécanique dans la chimie du vivant. médecine/sciences.
- Orr, A.W., Helmke, B.P., Blackman, B.R., & Schwartz, M.A. (2006). Mechanisms of mechanotransduction. Developmental cell, 10 1, 11-20 .
- Humphrey, J.D., Dufresne, E.R., & Schwartz, M.A. (2014). Mechanotransduction and extracellular matrix homeostasis. Nature Reviews Molecular Cell Biology, 15, 802-812.
- Chiquet, M., Gelman, L., Lutz, R., & Maier, S. (2009). From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochimica et biophysica acta, 1793 5, 911-20.
- D’Urso, M., & Kurniawan, N.A. (2020). Mechanical and Physical Regulation of Fibroblast–Myofibroblast Transition: From Cellular Mechanoresponse to Tissue Pathology. Frontiers in Bioengineering and Biotechnology, 8.
- Argentati, C., Morena, F., Tortorella, I., Bazzucchi, M., Porcellati, S., Emiliani, C., & Martino, S. (2019). Insight into Mechanobiology: How Stem Cells Feel Mechanical Forces and Orchestrate Biological Functions. International Journal of Molecular Sciences, 20.
- Schleip, R. (2016). Mechanotransduktion: von der zellulären Ebene bis zum ganzen Körper. Osteopathische Medizin, 17, 16-21.
- Tschumperlin, D.J., Ligresti, G., Hilscher, M.B., & Shah, V.H. (2018). Mechanosensing and fibrosis. Journal of Clinical Investigation, 128, 74–84.
- Yang, S., & Plotnikov, S.V. (2021). Mechanosensitive Regulation of Fibrosis. Cells, 10.
- Theise, N.D. (2005). Now you see it, now you don’t. Nature, 435, 1165-1165.
- Benias, P.C., Wells, R.G., Sackey-Aboagye, B., Klavan, H.L., Reidy, J.J., Buonocore, D.J., Miranda, M., Kornacki, S., Wayne, M., Carr-Locke, D.L., & Theise, N.D. (2018). Structure and Distribution of an Unrecognized Interstitium in Human Tissues. Scientific Reports, 8.
- Cenaj, O., Allison, D.H., Imam, R., Zeck, B., Drohan, L.M., Chiriboga, L.A., Llewellyn, J., Liu, C., Park, Y.N., Wells, R.G., & Theise, N.D. (2020). Interstitial spaces are continuous across tissue and organ boundaries in humans. bioRxiv.