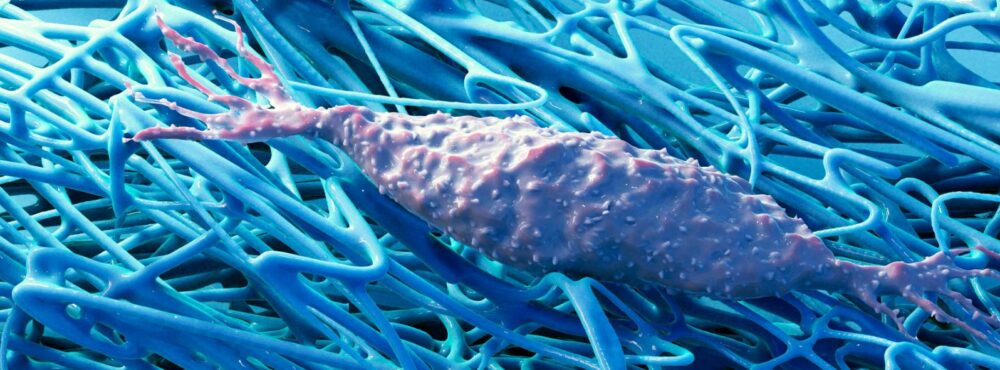
Des origines de la Matrice Extra-Cellulaire…
Comme le rappelle le paléontologue Neil Shubin dans son livre fascinant consacré aux étapes cruciales de l’évolution des corps « au commencement était le poisson », si les 4,5 Ga de l’histoire de la vie sont replacés sur une échelle d’une année, les premiers êtres pluricellulaires apparaissent en octobre …. et l’homme le 31 décembre ! De janvier à septembre, 3,5 Ga pendant lesquels, les conditions inhospitalières de la Terre des origines ont concouru à engendrer, à partir de la matière inorganique originelle, toute une multitude de matériel moléculaire préalable à la vie. Les premières cellules sont nées de cette évolution abiotique, toutes tirant leurs ressources énergétiques des mêmes processus d’oxydo-réduction 1 (transfert d’électron couplé à des protons). Se livrant une lutte sans merci pour la survie, des multitudes de formes de vie unicellulaires n’ont cessé de proliférer en expérimentant les voies les plus improbables, sélectionnant les meilleures d’entre elles, prenant des formes inimaginables dont la plupart ont disparu. Toutes ces « expériences évolutives » successives ont permis un foisonnement extrêmement diversifié d’outils qui ont fourni aux cellules tous les matériaux nécessaires à l’élaboration des premières enceintes multicellulaires. Selon Kloareg et al 2, « la multicellularité a évolué au moins 25 fois au cours de l’histoire évolutive des eucaryotes, mais seule une poignée de ces lignées multicellulaires comprend ce qui pourrait être considéré comme des organismes multicellulaires complexes. ».
Suite à la Grande Oxydation, survenue il y a 2,35 Ga, déclenchée par l’action des cyanobactéries photosynthétiques et à l’endosymbiose des mitochondries 3, 4 fournissant aux cellules eucaryotes des ressources énergétiques démultipliées, le vivant va changer d’échelle vers -850 millions d’années. Répondant à la pression de sélection intense qui s’exerçait sur elles, les cellules auraient trouvé avantage à se rassembler en développant une Matrice Extra-Cellulaire (MEC) pour optimiser leurs ressources en nutriments et échapper à la prédation en créant les premiers organismes multicellulaires 5. L’expansion de la MEC a joué un rôle central dans l’acquisition de la multicellularité complexe, définie comme possédant un plan corporel macroscopique composé de plusieurs types de cellules et construit par des programmes de développement impliquant division et différenciation cellulaire. Fournissant aux cellules un support pour s’arrimer et/ou s’agréger entre elles, les MEC qu’elles sécrètent forment des réseaux supramoléculaires complexes, à la fois rigide et flexible, les protégeant mécaniquement de l’écrasement aussi bien en milieu aquatique contre la pression de l’eau 6 que terrestre, antigravitaire 7. Tout en aménageant des espaces liquidiens propices aux échanges nutritifs et à l’élimination des déchets. Elles sont également très impliquées dans la signalisation essentielle au développement et à la migration cellulaire et aux réponses de défense, particulièrement l’immunité innée 8, 2.

5.
… aux organisations fasciales des animaux
L’évolution de cette multicellularité complexe concerne aussi bien les algues, les champignons et les plantes que les animaux avec des MEC extrêmement diverses mais dont les structures et les fonctions présentent des convergences étonnantes. Les MEC des plantes forment des structures rigides, composées majoritairement de fibres de cellulose semi-cristalline fournissant l’ancrage pour les autres composants, notamment pour des glycanes réticulants, et apportant la « charpente mécanique » alors que d’autres molécules comme les pectines aménagent des espaces matriciels poreux propices aux échanges et enveloppant les autres composants. Les MEC animales, nécessairement dynamiques, construisent des architectures membraneuses plus souples avec des éléments de soutien osseux extrêmement rigides presque minéraux à partir de protéines de structure (collagènes, élastine et fibrilline, laminines, etc.) et des inclusions interstitielles, incompressibles tout en permettant circulation et échanges. Ces espaces liquidiens sont structurés par des molécules aux propriétés uniques de tampon, d’hydratation, de liaison et de résistance à la force, les glycosaminoglycanes (GAG) sulfatés (héparane sulfate ou héparine, chondroïtine sulfate, kératane sulfate et dermatane sulfate) formant des macromolécules de protéoglycanes (PG), liés à une tige protéique spécifique et un GAG non sulfaté, l’acide hyaluronique (AH). Structurellement, toutes ces MEC présentent schématiquement deux typologies spécifiques, qui se mêlent l’une à l’autre, selon qu’elles assurent leur intégrité face aux contraintes physiques environnementales ou constituent un substrat liquidien, reproduisant le milieu marin originel, répondant aux besoins nutritifs ou immunitaire. Les structures fibreuses des plantes et membraneuses des animaux répondent à la première nécessité alors que les pectines ou les protéoglycanes aménagent des espaces d’échanges liquidiens indispensables à la vie cellulaire.


Chez les animaux, avec la complexification des corps, la MEC a évolué pour construire les tissus à partir desquels se forment les organes abritant des cellules spécialisées dans un certain nombre de fonctions précises contrairement aux cellules primitives omnipotentes. Leurs organismes multicellulaires complexes possède ainsi un certain nombre d’organes composant un certain nombre d’appareils assurant une fonction spécifique : respiratoire, circulatoire, urinaire, cutané, hypothalamo-hypophysaire ou digestive. Histologiquement et anatomiquement pour chaque organe, on retrouve les deux types de MEC évoquées précédemment : une MEC interstitielle associée à la fonction de l’organe et répondant aux besoins propres des cellules spécialisées le constituant et une autre structurante lui conférant sa forme et sa connexion à l’ensemble de l’organisme. Cette dernière constitue un lacis continu entremêlant l’ensemble des organes pour les arrimer à l’enveloppe corporelle, spécialisée dans la locomotricité.
Locomotricité et évolution du système myofascial de l’enveloppe corporelle
Auparavant assurée par les cils et les flagelles des cellules, les organismes multicellulaires se sont dotés d’appareils neuro-musculaires complexes capables de propulser l’ensemble de leur corps. Phylogénétiquement, le neurobiologiste Daniel Wolpert avance d’ailleurs l’hypothèse que neurones comme cellules musculaires se soient développés afin de répondre à cette nécessité locomotrice. Il en veut pour preuve l’ascidie qui possède un système neuro-musculaire dans la première partie, animale, de sa vie qu’elle digère lorsqu’elle se fixe à un support minéral dans la seconde, végétale. L’évolution de la MEC de l’enveloppe corporelle chez les animaux serait donc intimement liée au développement du système neuro-musculaire. De plus, certains travaux 9, 10 montrent que l’acquisition de capacités locomotrices de plus en plus performantes soit corrélée à une adaptation spécifique de la mécano-sensorialité, impliquant aussi bien le toucher et que la proprioception.
Chez les vertébrés, l’évolution de la locomotricité est marquée par l’adaptation progressive aux contraintes gravitaires qui semble s’être opérée en trois grandes étapes successives :
- La reptation : la contraction simultanée des groupes épaxiaux et hypaxiaux, se propage par vague, segment par segment et de manière alternative entre les côtés droit et gauche tout au long de l’axe vertébral en direction cranio-caudale 11. Cette alternance rythmique génère la force de propulsion ondulante caractéristique des vertébrés aquatiques et des poissons en particulier.
- La traction : générée par les membres des êtres terrestres produisant des mouvements alternés avant arrière et inversement pour progresser tout en rampant sur le ventre. Depuis le Tiktaalik 12, premier tétrapode à posséder une ébauche d’omoplate, c’est le mode de déplacement typique des reptiles.
- La suspension sur les membres : elle permet le transport des structures axiales sans qu’elles restent en contact avec le sol, caractérisée par deux types de locomotion suivant la vitesse de déplacement avec des mouvements pendulaires pour la marche (ou le pas) ou des impulsions pour la course (ou le trot et le galop). Mode de déplacement spécifique des mammifères leur permettant de s’affranchir des contraintes gravitaires, elle s’effectue essentiellement par la quadrupédie, la bipédie alternée chez l’homme représentant une exception.
Il est remarquable que chacune de ces étapes conserve les acquis de la précédente. Ainsi, si les reptiles utilisent la traction alternée de leurs membres, leur axe vertébral continue d’onduler alors que les mammifères conservent dans leur schéma moteur ces deux modes d’action auxquels s’ajoutent leur capacité à se hisser sur leurs pattes dont seule l’extrémité reste en contact au sol. Cette évolution nécessite une aptitude motrice de plus en plus performante mêlant puissance et finesse pour lesquelles la proprioception de l’ensemble du système myofascial de l’enveloppe corporelle et les capacités tactiles des extrémités apportent les informations mécano-sensorielles essentielles au réglage neuro-mécanique 9. Bien évidemment, s’y ajoutent les informations sensorielles visuelles et labyrinthiques des organes céphaliques.
Organisation myofasciale de l’enveloppe corporelle
Anatomiquement, comme le décrit la professeur Carla Stecco dans son « Atlas Fonctionnel du système fascial humain », l’enveloppe corporelle humaine présente une organisation spécifique héritée de cette évolution. Elle présente de manière systématique une stratification sous la couche épithéliale du revêtement cutané avec le fascia superficiel qui sépare l’hypoderme, ou subcutis, en deux couches : le tissu adipeux superficiel (TAS), directement sous cutané, et le tissu adipeux profond (TAP), entre le fascia superficiel et le fascia profond. Les TAS et TAP s’avèrent assez similaires, différant principalement par l’orientation des rétinaculums cutanés qui assurent liaison entre le derme et le fascia superficiel et entre ce dernier et le fascia profond. Les espaces délimités par les retinaculums constituent des compartiments remplis de lobules graisseux.

Coupe schématique de l’enveloppe corporelle présentant la structure de l’hypoderme avec de la superficie à la profondeur la peau, le TAS, le fascia superficiel, le TAP et le fascia profond enveloppant les fibres musculaires.
Cette stratification s’observe sur toute la surface de la paroi corporelle avec quelques particularités locales en raison du rôle fonctionnel spécifique de certaines régions :
- La galéa capitis qui enveloppe le crâne où l’espace entre fascia superficiel et profond est très réduit sans présence de graisse
- La présence de muscles sous cutanés insérés dans le fascia superficiel, très présent chez les animaux (panniculus carnosus), n’est conservé que pour les muscles platysma du cou, le système musculaire aponévrotique superficiel, le sphincter anal externe de la région anale et le muscle dartos du scrotum
- Quelques lignes d’adhésions où les fasciae superficiel et profond adhèrent séparant l’hypoderme en quadrants
- Les faces palmaires et plantaires des mains et des pieds formés par la fusion des deux fasciae, le TAP étant totalement absent et le TAS très mince afin d’arrimer très fortement la peau aux fasciae. Comme nous l’avons évoqué précédemment, cette conformation permet à ces zones de contact d’apporter des informations aussi bien tactiles que proprioceptive extrêmement précises pour le réglage locomoteur.

Si le fascia superficiel est abordé dans l’atlas, c’est principalement le fascia profond qui est au centre des descriptions détaillées de la Pr Stecco. Contrairement aux ouvrages anatomiques classiques le décrivant comme un tissu conjonctif dense irrégulier du fait de l’enchevêtrement apparent des fibres visibles à l’œil nu, elle suggère que le fascia profond est un tissu bien organisé. Grâce à des méthodes de dissection réalisées sur des cadavres frais non embaumés, elle montre que le fascia profond est en réalité constitué de deux ou trois couches membranaires adjacentes suivant les régions (3 pour les zones axiales, 2 pour les membres). Pour chacune des couches, des fibres collagènes bien organisées et denses présentent une orientation unique permettant la mise en action directionnelle précise des fibres musculaires connectées à chaque lame lors de leur contraction.

Elle distingue deux types de couches de fasciae profonds qui différent aussi bien structurellement que fonctionnellement :
- Les fasciae aponévrotiques qui forment nappes fasciales engainant les grands muscles du tronc et se prolongeant vers les membres comme des manchons. Ils relient ainsi l’ensemble des muscles entre eux en formant un continuum directionnel définissant des lignes d’action spécifiques afin de maintenir la posture et de coordonner les mouvements.
- Les fasciae épimysiaux qui enveloppent les corps de chaque muscle au sein desquels ils se prolongent par le périmysium et l’endomysium qui organisent des poches imbriquées successives. Les myofibrilles sont finalement disposées dans les structures alvéolaires formées par les enceintes endomysiales dont la direction des fibres détermine la ligne d’action des forces qui sont transmises aux périmysiums puis aux épimysiums.

(A) Schéma de l’organisation de l’épimysium, du périmysium et de l’endomysium dans le muscle
(B) Représentation schématique des zones de jonction entre le périmysium épais et l’endomysium des fibres musculaires dans la couche superficielle du fascicule.
(C) Représentation schématique des myofibrilles d’une cellule musculaire individuelle résidant dans le réseau en nid d’abeille de l’endomysium.
A droite : coupe histologique montrant l’insertion des fibres musculaires dans le réseau fascial (source – « Atlas fonctionnel du système fascial humain » de la Pr Carla Stecco
Ainsi, l’organisation structurelle de ces fasciae permet de créer de manière locale des organes musculaires produisant des forces par contraction des cellules musculaires qui sont transmises de manière précise aux points d’ancrage des fasciae épimysiaux. Afin que l’ensemble de ces organes soient coordonnés mécaniquement entre eux, les fasciae aponévrotiques véhiculent des informations de réglage nécessaires au maintien postural et à la précision des mouvements 13. Si l’on devait employer une analogie, on pourrait comparer le réseau myofascial à un orchestre où chaque instrument joue sa partition pendant que le chef d’orchestre synchronise chacun d’entre eux afin que la cacophonie devienne une symphonie. Cette description de l’enveloppe corporelle présente la couche fasciale profonde comme une seconde peau dévolue à la locomotricité et la parfaite harmonie des mouvements suppose aussi bien des propriétés rhéologiques viscoélastiques propres à assurer le glissement des éléments fasciaux entre eux que de nombreux capteurs mécanosensoriels fournissant les informations nécessaires à la régulation de la coordination chorégraphique.
A suivre : De Corporis Fabrica II : L’interstitium au coeur de la santé fasciale
Bibliographie
- Bromberg, Y., Aptekmann, A.A., Mahlich, Y., Cook, L., Senn, S., Miller, M., Nanda, V., Ferreiro, D.U., & Falkowski, P.G. (2022). Quantifying structural relationships of metal-binding sites suggests origins of biological electron transfer. Science Advances, 8.
- Kloareg, B., Badis, Y., Cock, J.M., & Michel, G. (2021). Role and Evolution of the Extracellular Matrix in the Acquisition of Complex Multicellularity in Eukaryotes: A Macroalgal Perspective. Genes, 12.
- Sagan, L.G. (1967). On the origin of mitosing cells. Journal of theoretical biology, 14 3, 255-74 .
- Gray, M.W. (2017). Lynn Margulis and the endosymbiont hypothesis: 50 years later. Molecular Biology of the Cell, 28, 1285 – 1287.
- Özbek, S., Balasubramanian, P.G., Chiquet‐Ehrismann, R., Tucker, R.P., & Adams, J.C. (2010). The Evolution of Extracellular Matrix. Molecular Biology of the Cell, 21, 4300 – 4305.
- Yancey, P.H., & Siebenaller, J.F. (2015). Co-evolution of proteins and solutions: protein adaptation versus cytoprotective micromolecules and their roles in marine organisms. The Journal of Experimental Biology, 218, 1880 – 1896.
- Volkmann, D., & Baluška, F. (2006). Gravity: one of the driving forces for evolution. Protoplasma, 229, 143-148.
- Fierro Morales, J.C., Xue, Q., & Roh-Johnson, M. (2022). An evolutionary and physiological perspective on cell-substrate adhesion machinery for cell migration. Frontiers in Cell and Developmental Biology.
- Aiello, B.R., Westneat, M.W., & Hale, M.E. (2017). Mechanosensation is evolutionarily tuned to locomotor mechanics. Proceedings of the National Academy of Sciences, 114, 4459 – 4464.
- Hale, M.E. (2021). Evolution of touch and proprioception of the limbs: Insights from fish and humans. Current Opinion in Neurobiology, 71, 37-43.
- Perry, S.F., Similowski, T., Klein, W., & Codd, J.R. (2010). The evolutionary origin of the mammalian diaphragm. Respiratory Physiology & Neurobiology, 171, 1-16.
- Shubin, N.H., Tabin, C.J., & Carroll, S.B. (1997). Fossils, genes and the evolution of animal limbs. Nature, 388, 639-648.
- Stecco, L., & Stecco, C. (2009). Comprar Fascial Manipulation. Practical Part | Luigi Stecco | 9788829919789 | Piccin.
- Robert Schleip, Carla Stecco, Mark Driscoll, Peter Huijing (2021). Fascia: The Tensional Network of the Human Body. The science and clinical applications in manual and movement therapy. 2nde Edition
- Frantz, C., Stewart, K.M., & Weaver, V.M. (2010). The extracellular matrix at a glance. Journal of Cell Science, 123, 4195 – 4200.